Platforme de Nanoradioenhancer

Une nouvelle ère thérapeutique pour des millions de personnes atteintes d’un cancer
La plupart des personnes atteintes d’un cancer nécessitant un traitement souffrent d’une maladie locale (c’est-à-dire, d’une seule tumeur primaire) au moment du diagnostic, ou bien ont suivi un traitement pour une maladie locale, mais celui-ci s’est avéré inefficace. Les personnes atteintes d’une maladie métastatique (c’est-à-dire, une maladie dans laquelle des tumeurs se sont propagées au-delà de la tumeur primaire) sont moins nombreuses.
La radiothérapie est le traitement le plus largement répandu dans la prise en charge des personnes atteintes d’un cancer local ou d’un cancer local et métastatique, et concerne chaque année 12 millions de nouveaux patients dans le monde.1 Associée à d’autres thérapies telles que la chirurgie, la chimiothérapie ou les thérapies ciblées, elle donne des résultats positifs chez de nombreux patients. Toutefois, malgré les avancées technologiques qui augmentent l’efficacité de l’irradiation dans des zones spécifiques et bien définies, des lésions des tissus normaux restent inévitables aux doses requises pour une radiation efficace.2 Par conséquent, l’efficacité du traitement par radiothérapie reste limitée par la dose qui peut être administrée.2
Le nanoradioenhancer first-in-class NBTXR3 est conçu pour augmenter la dose de radiothérapie absorbée et déposée à l’intérieur des cellules tumorales sans accroître la dose dans les tissus sains environnants, détruisant ainsi la tumeur cible et amorçant la réponse immunitaire sur les tumeurs métastatiques. En augmentant de manière significative le potentiel de destruction tumorale de la radiothérapie sans augmenter les lésions des tissus sains, NBTXR3 est une réponse potentielle aux besoins de millions de personnes atteintes d’un cancer.
Une intégration parfaite au paysage thérapeutique existant
NBTXR3 est conçu pour augmenter de manière significative l’énergie déposée par la radiothérapie à l’intérieur des cellules tumorales afin d’induire une mort cellulaire tumorale significative sans augmenter les dommages causés aux tissus sains environnants.
NBTXR3 en bref
Administré par une injection unique directement dans une tumeur maligne avant une radiothérapie ionisante conventionnelle
NBTXR3 possède des propriétés physiques uniques qui permettent une accumulation locale plus importante du rayonnement dans les cellules cancéreuses
Dès son activation, NBTXR3 augmente jusqu’à 9 fois l’énergie déposée par la radiothérapie dans les cellules tumorales injectées, par rapport à un traitement par radiothérapie seule.3 Les données cliniques suggèrent que le mécanisme d’action de NBTXR3 entraîne par la suite une destruction importante des cellules tumorales sans aggravation des dommages causés aux tissus sains environnants.4 Dans la mesure où les nanoparticules NBTXR3 reviennent à leur état inactif après chaque exposition aux rayonnements, il est possible d’administrer plusieurs traitements de radiothérapie à une tumeur après une injection unique de NBTXR3.
Implications en immuno-oncologie
Les premières données cliniques suggèrent que NBTXR3 activé par radiothérapie pourrait rendre les cellules cancéreuses plus visibles pour le système immunitaire et amorcer la réponse immunitaire de l’organisme. Nous pensons que cela peut se produire de plusieurs manières. Un mécanisme implique la libération de modèles moléculaires associés aux dommages qui sont reconnus par les cellules immunitaires comme un signe de stress ou de blessure cellulaire.5 Une réponse immunitaire contre la tumeur primaire et les cellules métastatiques peut alors être déclenchée en raison de la mort cellulaire immunogène, à savoir un type de mort cellulaire qui entraîne l’activation du système immunitaire. En outre, des études ont montré la capacité de NBTXR3 à augmenter l’expression des protéines de surface cellulaire qui améliorent la présentation des antigènes tumoraux aux cellules immunitaires, avec comme conséquence possible une de la reconnaissance et de la destruction des cellules cancéreuses.6
NBTXR3 dans le carcinome épidermoïde de la tête et du cou (HNSCC)
Le HNSCC se situe au sixième rang des tumeurs malignes les plus fréquentes dans le monde, et 40 % des patients touchés sont des personnes de 70 ans ou plus. En raison de leur fragilité liée à de multiples comorbidités, ces patients ne peuvent recevoir des traitements agressifs.7 Devant l’urgence de trouver des thérapies plus efficaces et mieux tolérées, adaptées à ces patients particulièrement vulnérables, Nanobiotix a choisi d’évaluer la tolérance et l’efficacité de NBTXR3 activé par radiothérapie dans cette population vulnérable.
En 2019, la FDA américaine a délivré la désignation Fast Track pour l’étude de NBTXR3 activé par radiothérapie associée ou non au Cetuximab chez les patients atteints de HNSCC localement avancé qui n’étaient pas éligibles à la chimiothérapie à base de platine.
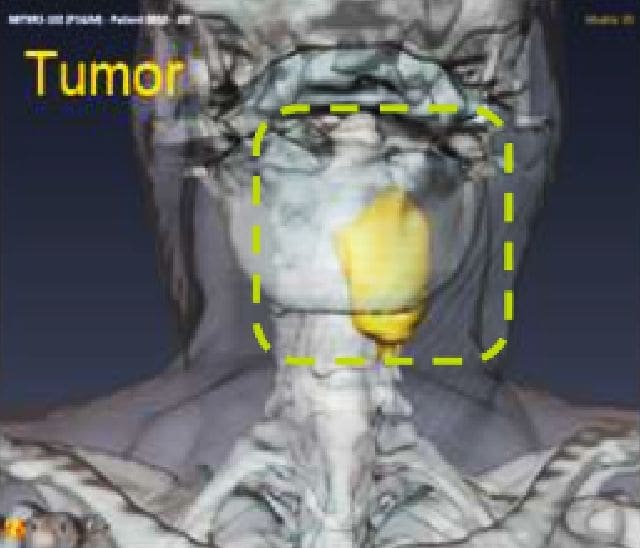
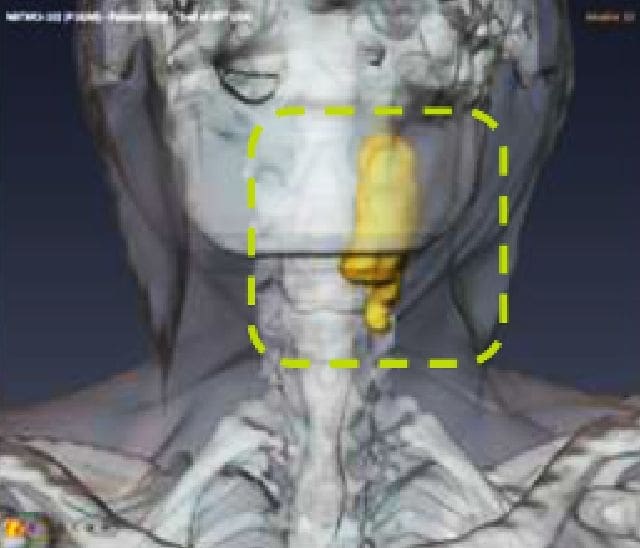
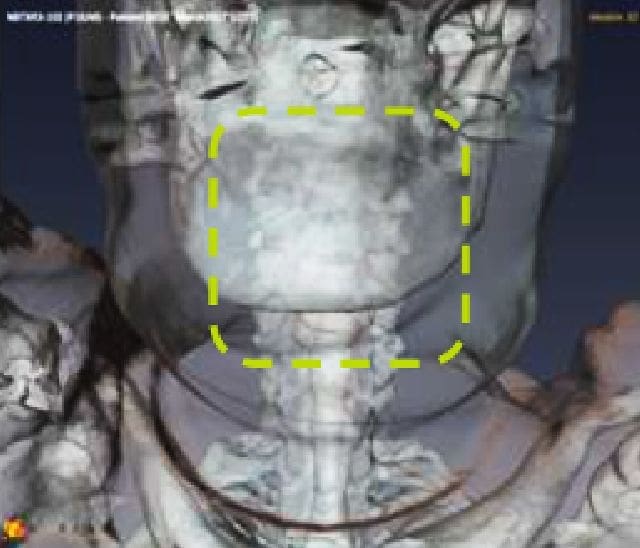
Les résultats préliminaires positifs d'un essai de phase 1 d'escalade de dose et d'expansion de dose suggèrent que NBTXR3 pourrait améliorer les résultats du traitement chez les patients atteints de HNSCC et pourrait devenir une option thérapeutique importante, en particulier pour les patients vulnérables qui ne sont pas candidats à d'autres traitements. Un essai d'enregistrement mondial de phase 3 évaluant NBTXR3 dans cette population est actuellement en cours.
Vers un radioenhancer au mode d’action universel
Le mécanisme d’action de NBTXR3 repose sur la physique et non sur la biologie ou la chimie. Par conséquent, nous estimons que ses effets pourront être étendus à un large spectre de tumeurs solides et de voies de traitement. Dans un essai clinique de phase 2/3 portant sur 176 patients atteints de sarcome des tissus mous, les patients traités avec NBTXR3 en association avec une radiothérapie ont enregistré des taux de réponse pathologique complète significativement plus élevée que le groupe ayant reçu la radiothérapie seule.8 Combinées à des données sur des stades précoces à tardifs dans plusieurs indications, dont les cancers de la tête et du cou, le cancer du foie et le cancer du pancréas, ces données indiquent que NBTXR3, activé par radiothérapie, pourrait fournir une nouvelle option de traitement pour tout un spectre de tumeurs solides, utilisé seul ou en association avec d’autres thérapies.8 Combinées à des données sur des stades précoces à tardifs dans plusieurs indications, dont les cancers de la tête et du cou, le cancer du foie et le cancer du pancréas, ces données indiquent que NBTXR3, activé par radiothérapie, pourrait fournir une nouvelle option de traitement pour tout un spectre de tumeurs solides, utilisé seul ou en association avec d’autres thérapies.
Références: Baskar R, Lee K.A., Yeo R., Yeoh K.W. Cancer and Radiation Therapy: Current Advances and Future Directions. Int J Med Sci 2012; 9(3):193-199. doi:10.7150/ijms.3635. 2 Alonso-González C., González A., Menéndez-Menéndez J., Martínez-Campa C., Cos S. Melatonin as a radio-sensitizer in cancer. Biomedicines. 2020;8(8):247. doi:10.3390/biomedicines8080247 3 Maggiorella L., Barouch G., Devaux C., Pottier A., et al. Nanoscale radiotherapy with hafnium oxide nanoparticles. Future Oncol. 2012 Sep;8(9):1167-81. doi: 10.2217/fon.12.96. PMID: 23030491. 4. Zhang P., Marill J., Darmon A., Anesary N.M., Lu B., Paris S. NBTXR3 radiotherapy-activated functionalized hafnium oxide nanoparticles show efficient antitumor effects across a large panel of human cancer models. Int J Nanomedicine. 2021;16:2761-2773. doi:10.2147/IJN.S301182 5. Yu S., Wang Y., He P., et al. Effective combinations of immunotherapy and radiotherapy for cancer treatment. Front Oncol. 2022;12:809304. doi:10.3389/fonc.2022.809304 6. Darmon A., Zhang P., Marill J., Anesary N.M., Da Silva J., Paris S. Radiotherapy-activated NBTXR3 nanoparticles modulate cancer cell immunogenicity and TCR repertoire. Cancer Cell Int. 2022;22(1):208. doi:10.1186/s12935-022-02615-w 7. Fasano M., D’Onofrio I., Belfiore M.P., et al. Head and neck squamous cell carcinoma in elderly patients: role of radiotherapy and chemotherapy. Cancers (Basel). 2022;14(3):472. doi:10.3390/cancers14030472 8. Bonvalot S., Rutkowski P.L., Thariat J., et al. NBTXR3, a first-in-class radioenhancer hafnium oxide nanoparticle, plus radiotherapy versus radiotherapy alone in patients with locally advanced soft-tissue sarcoma (Act.In.Sarc): a multicentre, phase 2-3, randomised, controlled trial. Lancet Oncol. 2019;20(8):1148-1159. doi:10.1016/S1470-2045(19)30326-2